 全国服务热线
全国服务热线
1. 政策:《中国新药注册临床试验进展年度报告(2022年)》发布;首家过评三年后,同品种不再受理过评?
4. 企业大事件:百济神州PD-1在欧洲获批,并从诺华收回全球权益;友芝友生物港股上市;
9月7日,国家药监局药审中心发布《中国新药注册临床试验进展年度报告(2022年)》(下称《报告》)。
据悉,《报告》根据2022年度登记的药物临床试验信息,从药物类型、品种、适应症、申办者类型、注册分类、试验分类、试验分期、特殊人群试验、临床试验单位、临床试验首次登记用时、启动用时、数据监查委员会(DMC)、试验完成情况等角度对临床试验的总体趋势、主要特征等进行汇总分析。
《报告》显示,2022年,药物临床试验登记与信息公示平台登记临床试验总量达3410项(以临床试验登记号计),为历年最高,且临床试验启动效率进一步提升。2022年度共批准21个创新药(不含中药提取物和新增适应证品种),获准上市所用时间平均为7.6年,其中10个上市用时在5年内。
9月25日,CDE发布关于公开征求《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》意见的通知。
其中精确指出,“自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。”这或许意味着在如今过评几乎是挂网采购的最低门槛,不过评,不采购的大环境下,或将有大量“老批文”面临“退市”风险。
而之前发布的《化学药品注册分类改革工作方案》也提到,首家过评后,同通用名其他厂家品种必须在3年内完成一致性评价,未过评的,不予再注册。而此次《征求意见稿》再次重申了该意见,并对解决方法进行细化,不是不注册的问题,而是不再受理一致性评价的申请了。
当然,但也并非一刀切。比如对属于临床必需、市场短缺的,可提出延期评价申请。
9月20日,国家卫生健康委、国家药监局等6部门联合发布了《关于公布第二批罕见病目录的通知》。
共收录血管性血友病Ⅲ型、神经元蜡样脂褐质沉积症、新生儿持续肺动脉高压等86种罕见病,涉及血液科、皮肤科、风湿免疫科、儿科、神经内科、内分泌科等17个学科。
据了解,2018年5月,国家卫生健康委、国家药监局等5部门联合发布《第一批罕见病目录》,共纳入121种罕见病。截至目前,我国共有207种罕见病被纳入目录。
关于公开征求《罕见病基因治疗产品临床试验技术指导原则(征求意见稿)》意见的通知
9月12日,CDE连续发布了《罕见病基因治疗产品临床试验技术指导原则(征求意见稿)》《间充质干细胞防治移植物抗宿主病临床试验技术指导原则(征求意见稿)》两项指导原则。
前者是在近年来医药行业对罕见病药物研发热情持续不断的增加背景下,CDE收到多个罕见病基因治疗产品的沟通交流和临床试验申请,为指导和规范罕见病基因治疗产品的临床试验设计。其主要内容有概述、一般考虑、临床试验设计要点、风险管理四个部分。
9月15日,国家卫生健康委员会公告称自2023年9月20日起将猴痘纳入乙类传染病来管理,采取乙类传染病的预防、控制措施。
有关部门将猴痘作为新发突发传染病进行应对处置,充分的发挥多部门协同防控的及其重要的作用,考虑到猴痘疫情将在我国一定时期内持续存在,为进一步科学规范开展猴痘疫情防控工作,切实保障人民群众生命安全和身体健康,故有此决定。
随着出海“越来越卷、越来越难”,加之近来各项政策变动,BD交易趋势正在由外循环转向BD内循环,对于多数Biotech来说,未来转让商业化权益之路有了新的道路。
如今,2023年9月医药长期资金市场交易数据颇有亮点,其间中国医药BD交易共有8笔,其中license in分别为1笔,license out分别为4笔,国内交易3笔。
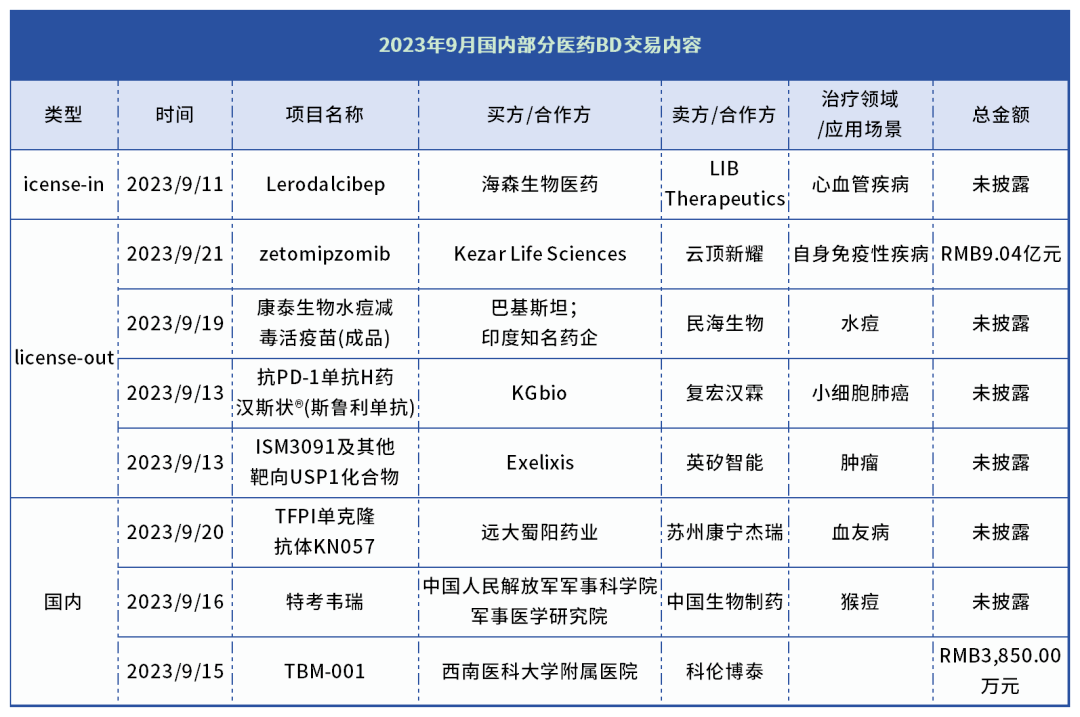
9月12日,英矽智能与Exelixis达成合作协议,后者获得英矽智能USP1抑制剂ISM3091的全球权益。根据协议条款,英矽智能将授予Exelixis开发和商业化ISM3091及其他靶向USP1化合物的全球独家许可,并在2023年第三季度获得8000万美元的预付款。
此外,英砍智能还有资格获得基于后续开发、商业化和销售的里程碑付款,以及未来产品净销售额的分级版税。
9 月 21 日,云顶新耀宣布,与 Kezar 公司订立合作及授权许可协议,据此,Kezar 授予云顶新耀独家授权许可,在大中华区、 韩国及若干东南亚国家开发、 生产及商业化 Kezar 的主要候选药物 zetomipzomib,其为一种用来医治包括狼疮性肾炎在内的一系列自身免疫性疾病的新同类首创选择性免疫蛋白酶体抑制剂。
云顶新耀将与 Kezar 共同推进全球 2b 期PALIZADE 临床研究,以评估两种剂量水平的 zetomipzomib 对活动期狼疮性肾炎患者的疗效及安全性。PALIZADE 全球研究已于 2023 年年中启动, 目标入组人数为 279 名患者。
9月20日,苏州康宁杰瑞生物科技有限公司(简称“苏州康宁杰瑞”)与远大生命科学集团有限公司(简称“远大生命科学”)全资子公司四川远大蜀阳药业有限公司(简称“远大蜀阳”)在今日共同宣布,双方已就苏州康宁杰瑞自主研发的组织因子途径抑制物(TFPI)单克隆抗体KN057大中华区的权益许可签署合作协议。
KN057是苏州康宁杰瑞自主开发,具有自主知识产权的一种单克隆抗体,通过特异性靶向TFPI,中和TFPI对FXa以及TF/FVIIa复合物的抑制作用,维持凝血酶水平,达到预防出血的作用,有望对伴或不伴抑制物的A型和B型血友病患者均发挥疗效。
9月12日,海森生物和LIB Therapeutics Inc.联合宣布,就海森生物在大中华区(包括中国大陆和港澳台地区)开发及商业化Lerodalcibep达成许可协议。根据协议条款,LIB Therapeutics将获得2000万美元的预付款,并有可能额外获得最高达3.05亿美元的临床、注册和销售里程碑付款。LIB Therapeutics也将根据Lerodalcibep在大中华区的年净销售额获得特许权使用费。
Lerodalcibep融合蛋白是由LIB Therapeutics开发的第三代长效PCSK9抑制剂,每月一针皮下注射,对解决当前临床降脂治疗中未被满足的需求极具潜力,有望助力更多高脂血症患者实现血脂控制达标,目前正处于3期临床开发阶段。
9月19日,百济神州公告称,百济神州瑞士与诺华签署《共同终止和释放协议》,共同终止授权协议。协议生效后,百济神州瑞士重新获得开发、生产和商业化替雷利珠单抗的全部全球权利,且无需支付特许使用费。
同日,百泽安欧盟委员会获批,单药用来医治既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者,同时FDA受理了百泽安的上市许可申请,用于一线治疗不可切除的局部晚期、复发或转移性的ESCC患者。
9月25日,友芝友生物正式在港股挂牌上市,以梦想灌溉的种子经过十三载的光阴已然生根发芽。
芝友生物凭借着自身专注双特异性抗体领域的研发实力,先后吸引包含石药集团、武汉高科等企业在内的6轮融资,累计融资金额高达7.12亿元。
成立至今,友芝友生物旗下有7款临床阶段候选药物管线,而在研药物大多数都是基于BsAb疗法的开发。
2023年9月22日,天境生物宣布艾伯维终止CD47抗体的合作协议,该决定由艾伯维基于此前的项目终止和策略调整所作出。协议终止从11月20日起效,天境生物重获CD47抗体的全球权益,协议终止不影响天境生物已经获得的2亿美元预付款+里程碑金额。Lemzoparlimab目前处于三期临床阶段,与阿扎胞苷联合一线治疗高危MDS。
9月21日,德国默克(Merck KGaA)和AI(AI)公司BenevolentAI和Exscientia分别达成两项独立的AI药物发现合作,并专注于肿瘤学、神经病学和免疫学中的三个靶点。
这项为期多年的合作将利用Exscientia的人工智能驱动的精准药物设计和发现能力,同时充分的利用默克在肿瘤学和神经炎症方面的疾病专业相关知识、临床开发能力。目前已确定三个潜在的first-in-class或best-in-class的靶点作为合作的初步重点。通过合作,默克和Exscientia可以在肿瘤学和免疫学或双方同意的其他疾病领域确定更多靶点。
9月19日,翰宇药业发布了重要的公告,公司及全资子公司翰宇药业(武汉)有限公司(以下简称“翰宇武汉”)与海外客户签署了3000万美元,约合人民币2.19亿元(含税)的GLP-1多肽原料药合同。占2022年经审计总收入的31.11%,占2022年经审计原料药业务的244.23%。
据悉,GLP-1受体激动剂一般是指胰高血糖素样肽-1受体激动剂,在治疗2型糖尿病和肥胖症方面表现出显著疗效。另外,GLP-1受体激动剂在非酒精性脂肪性肝炎(NASH)领域的应用也受到广泛关注。
9月14日,强生宣布品牌焕新,更换使用了135年的品牌标识,启用全新设计的徽标,并且在数字化界面等应用场景中凸显缩写的品牌标识“J&J”。同时宣布将旗下医疗科技和制药两大业务整合至强生(Johnson & Johnson)名下,以此将该两个细分市场与强生品牌建立更紧密的联系。
此次公告标志着强生持续数年的业务调整与“瘦身”已走到尾声。2021年11月,强生宣布了135年来最大一次架构调整,出售创可贴、婴儿爽身粉的健康消费品部门,分拆成为独立公司上市。
9月1日,联邦交易委员会(FTC)宣布,已经与安进达成协议,允许安进继续收购Horizon Therapeutics(Horizon)。
1.禁止安进将其任何一个产品与Tepezza 或 Krystexxa 捆绑销售,并且不得将与安进产品有关的任何一个产品回扣或合同条款作为销售的条件。
2.禁止安进用任何产品回扣或合同条款来挤压Tepezza 或 Krystexxa的竞争对手的市场,或使其处于不利地位。
3. 今后未经FTC允许,安进不得收购任何与TED和CRG有关的产品,包括已经经过FDA批准试验的还未商业化的产品;不得拥有任何生产、销售治疗TED和CRG的产品、生物仿制药、具有治疗等效性药物的企业的权益。
1.药闻回顾:4/5月CDE接连发布重磅指导原则;《第四批鼓励研发申报儿童药品建议清单》发布;BioNTech17亿美金...
2.药闻回顾!全国两会召开,企业代表建言建策;《化学仿制药参比制剂调整程序(试行)》发布;全国中成药集采将启动...
3.药闻回顾 第八批集采信息填报,肝素入集采;复方地芬诺酯片等多药多环节迎来强监管;阿斯利康80亿元拿下乐普生物ADC...
4.药闻回顾:药品网络销售禁止清单(第一版)出炉!祐儿医药获得JAK1/3抑制剂大中华区权益;泽纳仕生物获得超1.1亿美元B轮...
5.药闻回顾:超六成医药企业三季报报喜,提振行业信心;葛兰素史克双药HIV疗法获批上市;国家药监局发布仿制药参比制剂目录...
博腾股份为全球药企、新药研发机构等提供从临床前研究直至药品上市全生命周期所需的小分子药物、多肽、寡核苷酸、生物大分子以及基因与细胞治疗药物等一站式服务解決方案。我们的研发、生产和运营机构遍及中国(重庆、成都、上海、江西宜春、湖北应城、苏州、香港)、美国、比利时、瑞士、丹麦、斯洛文尼亚等地。公司通过十余年的沉淀,拥有领先的研发技术平台能力、完善的质量管理、EHS管理体系和良好的交付记录,为全世界创新药公司可以提供从小试、中试放大到商业化生产的核心服务和各种认证注册申报支持。我们先后通过NMPA、FDA、PMDA、WHO和EMA权威认证,产品线不乏全球年出售的收益超过10亿美金的重磅药,涉及抗艾滋病、肝炎、糖尿病、肿瘤、镇痛、抗心衰、降血脂、失眠、癫痫、抗流感、抗过敏等重大疾病治疗领域。